CLOSTRIDIUM DIFFICILE ASOCIADO A LA ATENCIÓN EN SALUD
Descargar PDF
El Clostridium difficile es considerado un patógeno nosocomial causante de la infección por C. difficile (ICD), asociado a brotes en la atención en salud cursando con cuadro clínico de diarrea por el uso de antibióticos, en especial en la población adulta. Los
altos sobrecostos por días de hospitalización, las complicaciones y mortandad que representa en los pacientes hacen que sea un problema en salud de carácter epidemiológico importante. Los Centros para el Control y la Prevención de Enfermedades de EE.UU. han catalogado a C. difficile como «una amenaza inmediata para la salud pública que requiere una acción urgente y agresiva» [1]. Este incremento del número y severidad de los casos viene de la mano con la aparición de una cepa denominada B1/NAP1/027, la cual tiene una mayor
virulencia debido a una producción aumentada de toxinas relacionándose con más fracasos terapéuticos debido a su resistencia a una nueva y amplia gama de antibióticos, con mayor mortalidad asociada a esta patología.
Sin embargo, el incremento de las infecciones por C. difficile no puede atribuirse solamente a esta cepa, sino que se han descrito otras como los ribotipos 001, 053, 106 y 078, los cuales tienen un mecanismo similar de hiperproducción de Toxinas.
Se estima que C. difficile es responsable de más de 400.000 infecciones y 29.000 muertes al año en Estados Unidos[2]. C. difficile ha superado a Staphylococcus aureus resistente a la meticilina como la bacteria más común causante de infecciones adquiridas durante la atención sanitaria en los hospitales comunitarios. Se calcula que la CDI es responsable de más de 4.800 millones de
dólares en costos sanitarios al año en los Estados Unidos[2].
En Colombia y en Latinoamérica, el conocimiento sobre el comportamiento epidemiológico de la infección por C. difficile se reduce a unas pocas publicaciones que no permiten establecer el impacto real y las características clínicas y epidemiológicas de la enfermedad. Un estudio realizado por la universidad de Cali durante 2012 – 2014 en un centro de alta complejidad hospitalaria informa que la prevalencia de Clostridium difficile hospitalaria en la institución fue de 10 por 10.000
pacientes hospitalizados[3]. C. difficile (o Bacillus difficile, como se denominó inicialmente) es una bacteria Grampositiva anaerobia, formadora de esporas que se distribuye ampliamente en el medio ambiente y la flora fecal de humanos y animales. Aislada por primera vez en 1935 por Hall y O’Toole a partir de muestras de heces de recién nacidos; en 1978 C difficile fue reconocido como causa de diarrea productor de colitis pseudomembranosa y en el 2002 se notifica la primera cepa hipervirulenta (NAP-1/B1/027).
Los principales modos de transmisión de C. difficile son el contacto directo (la vía fecal) y el contacto indirecto (fómites y superficies contaminadas). Hasta ahora no se ha confirmado que las rutas aéreas y alimentarias sean importantes para la transmisión de C. difficile. Se han descrito en gran medida en las salas de los hospitales; Sin embargo, hay cada vez más pruebas de que los pacientes «sanos» asintomáticos colonizados por CDI tienen el potencial de actuar como reservorio y fuente de
transmisión. El mecanismo de infección de CDI se da por la adquisición del microorganismo y la alteración de la microbiota intestinal. El C. difficile se defiende de los antibióticos y es resistente al jugo gástrico por medio de su espora que le confiere protección.
Cuando el microrganismo coloniza el intestino, se produce un daño directo en los enteritos causado por sus toxinas, la enterotoxina TcdA y una citotoxina TcdB; las dos toxinas están codificadas por el gen tcdA y tcdB respectivamente, la enterotoxina TcdA actúa principalmente sobre el epitelio intestinal, rompe las uniones intercelulares de los enterocitos y facilita el ingreso de la toxina B, provocando secreción de líquido, inflamación y necrosis tisular, la TcdB actúa como una potente citotoxina, activa los macrófagos y los mastocitos que a su vez, generan un aumento de la permeabilidad epitelial, producción de citocinas, infiltración de neutrófilos, producción de intermediarios de especies reactivas del oxígeno, activación de mastocitos, producción de sustancia P y el daño directo en la mucosa.
Algunas cepas de Clostridium conocidas como NAP1/BI/027 caracterizadas por contener un factor de virulencia adicional (toxina binaria) expresado a partir del operón cdtA (componente enzimático) y cdtB (componente de unión) con mecanismo patogénico aún no dilucidado del todo, pero que al parecer incrementa la adhesión de las cepas de C. difficile y actúa a nivel del citoesqueleto de la célula, provocando una mayor pérdida de líquidos, por lo que las cepas portadoras de dicha toxina se han asociado a una mayor virulencia y resistencia a los antibióticos fluoroquinolónicos más nuevos como la moxifloxacina. 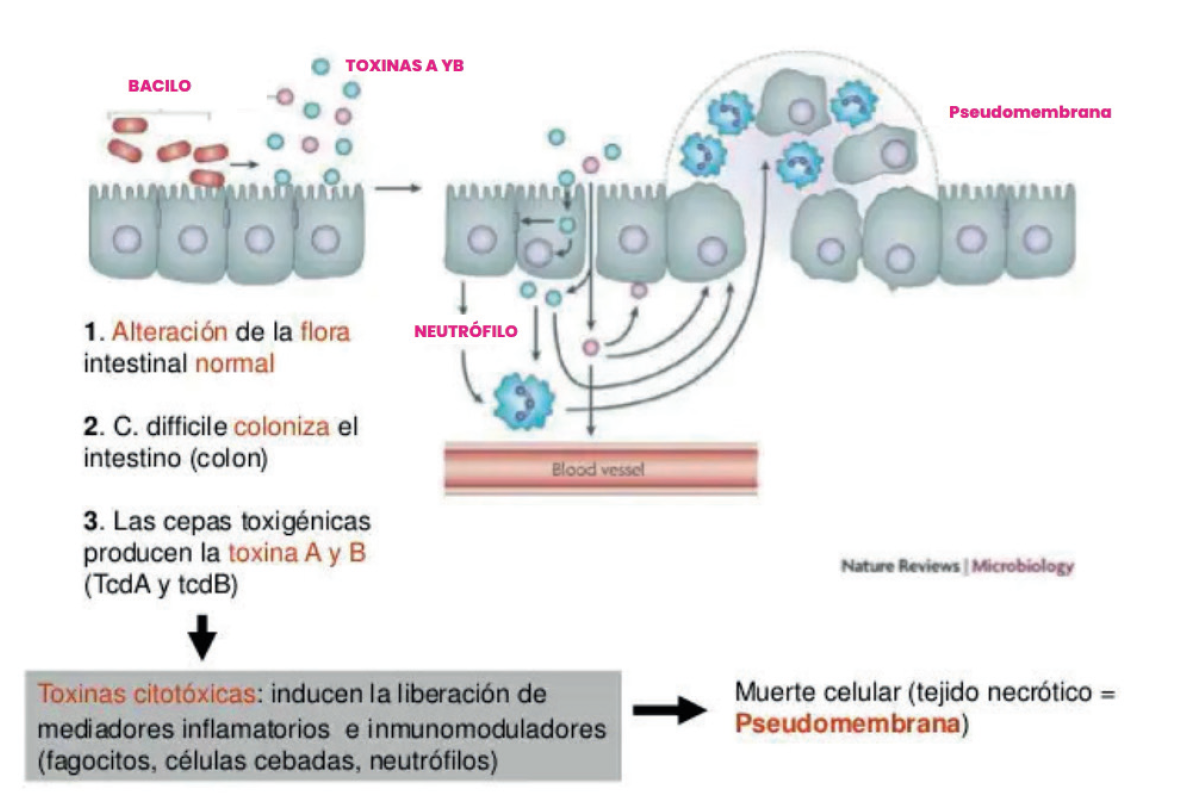
La infección por C. difficile tiene un amplio espectro de presentaciones clínicas, desde diarrea leve, auto limitada hasta diarrea grave, colitis pseudomembranosa y colitis fulminante
La mayoría de los pacientes desarrollan diarrea durante o poco después de tomar antibióticos, tambien se puede presentar diarrea de 8 a 10 semanas después de su uso. La infección por C. difficile tiene un amplio espectro de presentaciones
clínicas, desde diarrea leve, autolimitada hasta diarrea grave, colitis pseudomembranosa y colitis fulminante potencialmente mortal, que pueden conducir a la muerte. El síntoma más importante de la ICD es la diarrea acuosa, calambres, dolor abdominal, fiebre, anorexia y náuseas, por lo que pueden producirse una reacción leucocitoide, hipoalbuminemia y hemorragia colónica oculta.
La infección por C. difficile afecta principalmente a personas que han estado tomando antibióticos que actúan contra varios tipos de bacterias (antibióticos de amplio espectro), varios antibióticos diferentes al mismo tiempo, o aquellos que toman antibióticos a largo plazo; personas que se encuentran en un entorno de atención médica como un hospital o una residencia de ancianos durante mucho tiempo; afecciones subyacentes como enfermedad inflamatoria intestinal (EII), cáncer, enfermedad renal, sistema inmunológico debilitado, diabetes, tratamiento como quimioterapia, medicamentos como inhibidores de la bomba de protones (IBP) para reducir la cantidad de ácido del estómago.
Un estudio publicado por la Jurnal clinical of investigation observó que la IL-17 de producción de células T delta gamma proporciona defensa del huésped contra la infección neonatal y proporciona una explicación mecanicista de la resistencia clínicamente observada de los lactantes a C. difficile. La señalización de IL-17 es importante para el reclutamiento de neutrófilos a los tejidos locales durante otras infecciones bacterianas. Las células T γ δ productoras de IL-17A pueden ser mediadores particularmente importantes de la defensa de la mucosa durante las etapas iniciales de la vida posnatal.
Algoritmo Diagnóstico
Existen varios desafíos para diagnosticar CDI. Los enfoques de diagnóstico son complejos debido a la disponibilidad de múltiples estrategias de prueba; es de aclarar que Las pruebas de laboratorio no pueden distinguir entre colonización asintomática e infección sintomática por C. difficile. El Cultivo de heces para C. difficile si bien esta es la prueba más sensible, se asocia a falsos positivos por la presencia de otras cepas de C difficile no toxigenicas, esto puede superarse con un «cultivo toxigénico». No obstante, los cultivos de heces para C. difficile requieren mucha mano de obra, requieren cultivos para el desarrollo de microorganismos anaeróbicos y su tiempo de respuesta relativamente lento (48 a 96 horas), lo que los hace menos útiles clínicamente. La Detección de antígeno para C. difficile son pruebas rápidas (<1 hora) que detectan la presencia de antígeno de C. difficile glutamato deshidrogenasa (GDH). Debido a que los resultados de las pruebas de antígenos por sí solos son inespecíficos, las pruebas de antígenos se han empleado en combinación con pruebas de detección de toxinas, PCR o cultivo toxigénico. La Prueba de toxinas para C. difficile es un inmunoensayo enzimático que detecta la toxina A, la toxina B o ambas A y B, este ensayo se procesa el mismo día es económico y fácil de realizar.
La toxina C. difficile es muy inestable. La toxina se a temperatura ambiente y puede ser no detectable dentro de las dos horas posteriores a la recolección de una muestra de heces. Pruebas moleculares de PCR aprobadas por la FDA, que analizan los genes que codifican la toxina, son pruebas que se realizan el mismo día y que son altamente sensibles y específicas para detectar la presencia de un organismo C. difficile productor de toxina. Los análisis moleculares pueden ser positivos para C. difficile en personas asintomáticas y sin infección. Los pacientes con otras causas de diarrea pueden ser positivos, lo que puede llevar a un sobrediagnóstico y tratamiento.
El ensayo de neutralización de citotoxicidad en cultivo celular (CCNA) y el cultivo de heces toxigénicas, son los estándares de oro para la detección de toxina libre y cepas toxigénicas de C. difficile, tienen una utilidad muy limitada en el entorno clínico debido a los largos tiempos de respuesta (varios días) y los requisitos de mano de obra excesivos. Por lo tanto, estos ensayos se utilizan principalmente para la investigación.
Ensayos moleculares por LAMP (amplificación isotérmica mediada por bucle). Consiste en una reacción isotérmica de AAN que no requiere instrumentación de alto costo para su implementación. Los kit comerciales detectan el gen tcdA del locus de patogenicidad. Tiene alta sensibilidad y especificidad, pero es controvertido el hecho de que detecte tcdA ya que existen cepas toxina A negativas. Otros métodos diagnósticos son colondoscopia, sigmoidoscopia y tomografía.
Aunque en aproximadamente el 20% de los BIBLIOGRAFÍA pacientes, la CDI se resolverá dentro de los dos o tres días posteriores a la interrupción del antibiótico al que el paciente estuvo expuesto anteriormente, la CDI generalmente debe tratarse en base a la severidad de la infección. Para el episodio de diarrea leve a moderado, el antibiótico de elección es metronidazol por un período de 10 días, para el grupo de ICD severa vancomicina, y para ICD severa y complicada el tratamiento es manejo quirúrgico (colectomía total con ileostomía terminal).
Después del tratamiento, no se recomienda repetir la prueba de C. difficile en el paciente que ha resuelto la infección, ya que los pacientes a menudo permanecen colonizados.
Biosciences tiene disponible el kit “ RIDA QUICK CLOSTRIDIUM DIFFICILE TOXIN A/B” Referencia N0803, y “Clostridium difficile GDH+ Toxin A +Toxin B Combo Rapid Test Cassette “ Referencia Ref. ICD-635. Si es de su interés haremos llegar información complementaria a solicitud.
BIBLIOGRAFÍA
1. Furuya-Kanamori L, Marquess J, Yakob L, Riley TV, Paterson DL, Foster NF, Huber CA, Clements AC. Asymptomatic Clostridium difficile colonization: epidemiology and clinical implications. BMC Infect Dis 2015;15:516 – Incorporated as a section in Chapter 2.
2.https://openresearch-repository.anu.edu.au/bitstream/1885/112139/1/Furuya%20Kanamori%20Thesis%202017.pdf
3.http://www.scielo.org.co/pdf/inf/v21n1/0123-9392-inf-21-01-00009.pdf
4. https://nyulangone.org/conditions/clostridium-difficile-infections-inadults/diagnosis
5. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1082799
6. Lyerly, D.M. et al.: Clostridium difficile: lts disease and toxins. Clin. Microbio!. Rev. (1988); 1: 1-18.
7. Knoop, F.C. et al.: Clostridium difficile: Clinical disease and diagnosis. Clin. Microb. Rev. (1993); 6: 251-265.
8. Kelly, C.P. et al.: Clostridium difficile Colitis. New Engl. J. Med. (1994); 330: 257-262.
9. Sullivan, N.M. et al.: Purification and characterization of toxins A and B of Clostridium difficile. lnfect. lmmun. (1982); 35: 1032-1040.
10. Thomas, D.R. et al.: Postantibiotic colonization with Clostridium difficile in nursing home patients. J. Am Geriatr. Soc. 38, 415-420 (1990).
11. https://academic.oup.com/cid/article/66/7/e1/4855916
12. https://openresearchrepository.anu.edu.au/bitstream/1885/112139/1/Furuya%20Kanamori%20Thesis%202017.pdf
13. Khanna S, Aronson S, Kammer P, Baddour L, Pardi D. Gastric acid suppression and outcomes in Clostridium difficile infection: a population-based study. Mayo Clin Proc 2012; 87 (7): 636-42






Deja tu comentario
Debe iniciar sesión para escribir un comentario.